Строение белковой молекулы. Образование молекулы белка происходит за счет взаимодействия карбоксильной группы аминокислотного блока одной аминокислоты с α-аминогруппой другой аминокислоты, что можно выразить следующей схемой:
18
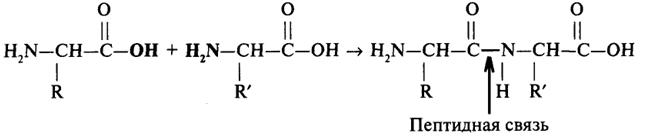
Каждую аминокислоту, входящую в состав белка, называют аминокислотным остатком. Аминокислотные остатки в молекуле белка соединены пептидными связями. Длина пептидной связи составляет 0,1325 нм, представляя собой среднюю величину между длинами одинарной С - N связи (0,146 нм) и двойной С = N связи (0,127 нм), т.е. пептидная связь частично имеет характер двойной связи. Это сказывается на свойствах пептидной группировки (рис. 2).
Свойства пептидной группировки:
- Пептидная группировка имеет жесткую планарную структуру, т.е. все атомы, входящие в нее, располагаются в одной плоскости.
- Атомы кислорода и водорода в пептидной группировке находятся в трансположении по отношению к пептидной С - N связи.
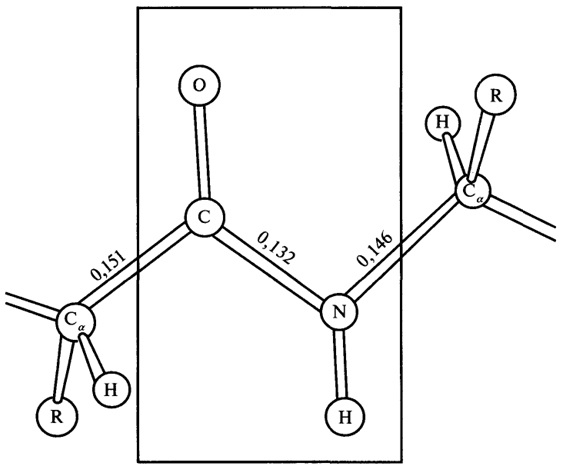
Рис. 2. Пептидная группировка (длины связей указаны в нм)
19
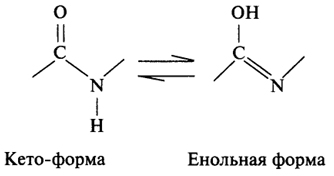
- Пептидная группировка может существовать в двух резонансных формах (кето- и енольной):
Эти свойства пептидной группировки определяют структуру полипептидной цепи, фрагмент которой представлен ниже:
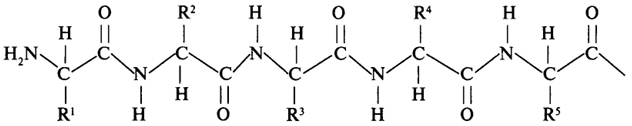
Полипептидная цепь состоит из регулярно повторяющихся участков, образующих остов молекулы, и вариабельных участков - боковых радикалов аминокислотных остатков. Полипептидная цепь имеет определенное направление, поскольку каждый из ее строительных блоков имеет разные концы: амино- и карбоксильную группы. Началом полипептидной цепи считают конец, несущий свободную аминогруппу (N-конец), а заканчивается полипептидная цепь свободной карбоксильной группой (С-конец).
Номенклатура пептидов. Рассмотрим номенклатуру пептидов на примере конкретного трипептида:
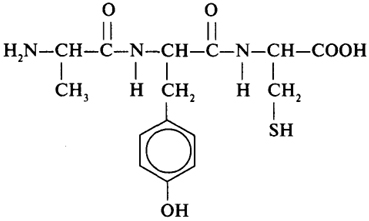
Аминокислотные остатки, за исключением последнего, в химическом отношении являются аминоацилами - радикалами аминокислот. Названия радикалов оканчиваются на -ил. Пептиды
20
именуют по названию аминоацилов, входящих в их состав; при этом название последнего аминокислотного остатка не изменяется. Исходя из этого, пептид, формула которого приведена выше, называется аланил-тирозил-цистеин.
Первичная структура белка. Под первичной структурой белка понимают порядок чередования аминокислотных остатков в полипептидной цепи. Первичная структура белка уникальна и детерминируется генами. К настоящему времени расшифрована первичная структура более тысячи белков из разных организмов, в том числе и человека.
Миоглобин чеовека (153 аминокислотных остатка):
Гли-лей-сер-асп-гли-глу-три-глн-лей-вал-лей-асн-вал-три-гли-лиз-вал-глу-ала-асп-иле-про-гли-гис-гли-глн-глу-вал-лей-иле-арг-лей-фен-лиз-гли-гис-про-глу-тре-лей-глу-лиз-фен-асп-лиз-фен-лиз-гис-лей-лиз-сер-глу-асп-глу-мет-лиз-ала-сер-глу-асп-лей-лиз-лиз-гис-гли-ала-тре-вал-лей-тре-ала-лей-гли-иле-лей-лиз-лиз-гли-гис-гис-глу-ала-глу-иле-лиз-про-лей-ала-глн-сер-гис-ала-тре-лис-гис-лиз-вал-про-иле-лиз-тир-лей-глу-фен-иле-сер-глу-цис-иле-иле-гли-вал-лей-гли-сер-лиз-гис-про-гли-асп-фен-гли-ала-асп-ала-глн-гли-ала-мет-асн-лиз-ала-лей-глу-лей-фен-арг-лиз-асп-мет-ала-сер-асн-тир-лиз-глу-лей-гли-фен-глн-гли.
Инсулин из поджелудочной железы человека, цепь А (21 аминокислотный остаток):
Гли-иле-вал-глу-глн-цис-цис-тре-сер-иле-цис-сер-лей-тир-глн-лей-глу-асн-тир-цис-асн;
цепь В (30 аминокислотных остатков):
Фен-вал-асн-глн-гис-лей-цис-гли-сер-гис-лей-вал-глу-ала-лей-тир-лей-вал-цис-гли-глу-арг-гли-фен-фен-тир-тре-про-лиз-тре.
Замена одного лишь аминокислотного остатка в полипептидной цепи может привести к аномальным явлениям. Примером тому служит замена в β-цепи гемоглобина человека остатка глутаминовой кислоты, занимающего шестое положение, на остаток валина. Результатом этого является тяжелое, передающееся по наследству заболевание - серповидноклеточная анемия.
Первичная структура белка предопределяет следующие уровни организации белковой молекулы.
Вторичная структура белка. Под вторичной структурой белка понимают способ укладки полипептидной цепи в упорядоченную структуру. По конфигурации выделяют следующие элементы вторичной структуры: α-спираль и β-складчатый слой.
Модель строения α-спирали, учитывающая все свойства пептидной связи, была разработана Л. Полингом и Р. Кори (1949 - 1951 гг.).
21
На рисунке 3, а изображена схема α-спирали, дающая представление об основных ее параметрах. Полипептидная цепь сворачивается в α-спираль таким образом, что витки спирали регулярны, поэтому спиральная конфигурация имеет винтовую симметрию (рис. 3, б). На каждый виток α-спирали приходится 3,6 аминокислотных остатка. Расстояние между витками или шаг спирали составляет 0,54 нм, угол подъема витка равен 26°. Формирование и поддержание α-спиральной конфигурации происходит за счет водородных связей, образующихся между пептидными группами каждого n-го и (п + 3)-го аминокислотных остатков. Хотя энергия водородных связей мала, большое количество их приводит к значительному энергетическому эффекту, в результате чего α-спиральная конфигурация довольно устойчива. Боковые радикалы аминокислотных остатков не участвуют в поддержании α-спиральной конфигурации, поэтому все аминокислотные остатки в α-спирали равнозначны.
В природных белках существуют только правозакрученные α-спирали.
β-Складчатый слой - второй элемент вторичной структуры. В отличие от α-спирали β-складчатый слой имеет линейную, а не стержневую форму (рис. 4). Линейная структура удерживается благодаря возникновению водородных связей между пептидными группировками, стоящими на разных участках полипептидной цепи. Эти участки оказываются сближенными на расстояние водородной связи между - С = О и HN - группами (0,272 нм).
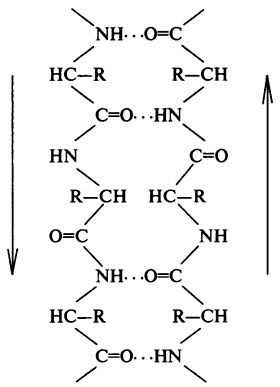
Рис. 4. Схематичное изображение
β-складчатого слоя (стрелками указано направление полипептидной цепи)
22
23
Вторичная структура белка определяется первичной. Аминокислотные остатки в разной степени способны к образованию водородных связей, это и влияет на образование α-спирали или β-слоя. К спиралеобразующим аминокислотам относятся аланин, глутаминовая кислота, глутамин, лейцин, лизин, метионин и гистидин. Если фрагмент белка состоит главным образом из перечисленных выше аминокислотных остатков, то на данном участке сформируется α-спираль. Валин, изолейцин, треонин, тирозин и фенилаланин способствуют образованию β-слоев полипептидной цепи. Неупорядоченные структуры возникают на участках полипептидной цепи, где сконцентрированы такие аминокислотные остатки, как глицин, серии, аспарагиновая кислота, аспарагин, пролин.
Во многих белках одновременно имеются и α-спирали, и β-слои. Доля спиральной конфигурации у разных белков различна. Так, мышечный белок парамиозин практически на 100% спирализован; высока доля спиральной конфигурации у миоглобина и гемоглобина (75%). Напротив, у трипсина и рибонуклеазы значительная часть полипептидной цепи укладывается в слоистые β-структуры. Белки опорных тканей - кератин (белок волос), коллаген (белок кожи и сухожилий) - имеют β-конфигурацию полипептидных цепей.
Третичная структура белка. Третичная структура белка - это способ укладки полипептидной цепи в пространстве. Чтобы белок приобрел присущие ему функциональные свойства, полипептидная цепь должна определенным образом свернуться в пространстве, сформировав функционально активную структуру. Такая структура называется нативной. Несмотря на громадное число теоретически возможных для отдельной полипептидной цепи пространственных структур, сворачивание белка приводит к образованию единственной нативной конфигурации.
Стабилизируют третичную структуру белка взаимодействия, возникающие между боковыми радикалами аминокислотных остатков разных участков полипептидной цепи. Эти взаимодействия можно разделить на сильные и слабые.
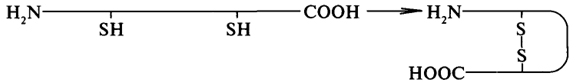
К сильным взаимодействиям относятся ковалентные связи между атомами серы остатков цистеина, стоящих в разных участках полипептидной цепи. Иначе такие связи называются дисульфидными мостами; образование дисульфидного моста можно изобразить следующим образом:
24
Кроме ковалентных связей третичная структура белковой молекулы поддерживается слабыми взаимодействиями, которые, в свою очередь, разделяются на полярные и неполярные.
К полярным взаимодействиям относятся ионные и водородные связи. Ионные взаимодействия образуются при контакте положительно заряженных групп боковых радикалов лизина, аргинина, гистидина и отрицательно заряженной СООН-группы аспарагиновой и глутаминовой кислот. Водородные связи возникают между функциональными группами боковых радикалов аминокислотных остатков.
Неполярные или ван-дер-ваальсовы взаимодействия между углеводородными радикалами аминокислотных остатков способствуют формированию гидрофобного ядра (жирной капли) внутри белковой глобулы, т.к. углеводородные радикалы стремятся избежать соприкосновения с водой. Чем больше в составе белка неполярных аминокислот, тем большую роль в формировании его третичной структуры играют ван-дер-ваальсовы связи.
Многочисленные связи между боковыми радикалами аминокислотных остатков определяют пространственную конфигурацию белковой молекулы (рис. 5).
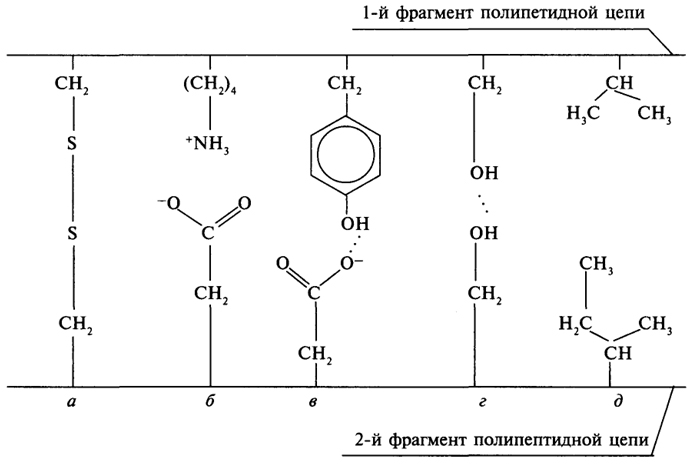
Рис. 5. Типы связей, поддерживающих третичную структуру белка:
а - дисульфидный мостик;
б - ионная связь;
в, г - водородные связи;
д - ван-дер-ваальсовы связи
25
Третичная структура отдельно взятого белка уникальна, как уникальна и его первичная структура. Только правильная пространственная укладка белка делает его активным. Различные нарушения третичной структуры приводят к изменению свойств белка и потере биологической активности.
Четвертичная стурктура белка. Белки с молекулярной массой более 100 кДа1 состоят, как правило, из нескольких полипептидных цепей со сравнительно небольшой молекулярной массой. Структура, состоящая из определенного числа полипептидных цепей, занимающих строго фиксированное положение относительно друг друга, вследствие чего белок обладает той или иной активностью, называется четвертичной структурой белка. Белок, обладающий четвертичной структурой, называется эпимолекулой или мультимером, а составляющие его полипептидные цепи - соответственно субъединицами или протомерами. Характерным свойством белков с четвертичной структурой является то, что отдельная субъединица не обладает биологической активностью.
Стабилизация четвертичной структуры белка происходит за счет полярных взаимодействий между боковыми радикалами аминокислотных остатков, локализованных на поверхности субъединиц. Такие взаимодействия прочно удерживают субъединицы в виде организованного комплекса. Участки субъединиц, на которых происходят взаимодействия, называются контактными площадками.
Классическим примером белка, имеющего четвертичную структуру, является гемоглобин. Молекула гемоглобина с молекулярной массой 68 000 Да состоит из четырех субъединиц двух разных типов - α и β/ α-Субъединица состоит из 141 аминокислотного остатка, a β - из 146. Третичная стурктура α- и β-субъединиц сходна, как и их молекулярная масса (17 000 Да). Каждая субъединица содержит простетическую группу - гем. Поскольку гем присутствует и в других белках (цитохромы, миоглобин), которые будут изучаться далее, хотя бы коротко обсудим структуру тема (рис. 6). Группировка гема представляет собой сложную копланарную циклическую систему, состоящую из центрального атома, который образует координационные связи с четырьмя остатками пиррола, соединенными метановыми мостиками (= СН -). В гемоглобине железо обычно находится в состоянии окисления (2+).
Четыре субъединицы - две α и две β - соединяются в единую структуру таким образом, что α-субъединицы контактируют только с β-субъединицами и наоборот (рис. 7).
26
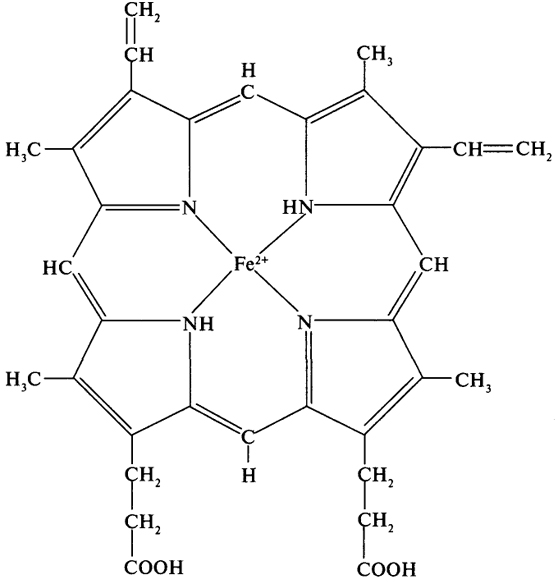
Рис. 6. Структура гема гемоглобина
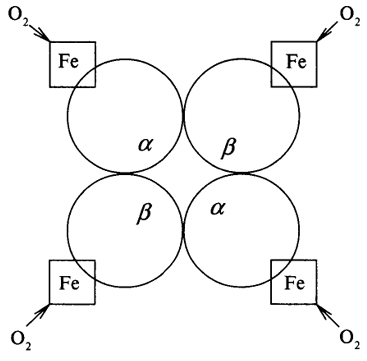
Рис. 7. Схематичное изображение четвертичной структуры гемоглобина:
Fe - гем гемоглобина
27
Как видно из рисунка 7, одна молекула гемоглобина способна переносить 4 молекулы кислорода. И связывание, и освобождение кислорода сопровождается конформационными изменениями структуры α- и β-субъединиц гемоглобина и их взаимного расположения в эпимолекуле. Этот факт свидетельствует о том, что четвертичная структура белка не является абсолютно жесткой.
28
1
Дальтон (Да) - единица массы, практически равная массе атома водорода.
